我院转化药学创制中心高端透皮制剂团队在慢性创面和肿瘤免疫治疗领域取得新进展
创面愈合尤其是慢性伤口愈合一直是临床上亟待解决的问题,以晚期糖尿病创面为例,持续的高血糖微环境导致皮肤微血管损伤和长期的炎症反应,当创面发生时,无法实现自我愈合。传统的治疗方法存在着治疗时间长,易感染,自身排斥、疗效不佳等问题。因此,慢性创面愈合需要更加安全且有效的治疗策略。
我院转化药学创制中心高端透皮制剂项目杜永忠教授团队发明了一种脂肪来源间充质干细胞外泌体嵌合细胞外基质温敏水凝胶,显著改善慢性创面的愈合和皮肤的再生。相关研究成果以“Adipose-Derived Mesenchymal Stem Cell-Derived Exosomes Biopotentiated Extracellular Matrix Hydrogels Accelerate Diabetic Wound Healing and Skin Regeneration”为题,于2023年9月发表在Advanced Science上(全文链接https://doi.org/10.1002/advs.202304023)。本文的第一作者为浙江大学药学院硕士生宋艳玲,通讯作者为浙江大学药学院杜永忠教授、浙江大学医学院附属邵逸夫医院整形外科谈伟强主任医师和浙江树人大学树兰医学院徐晓玲副研究员。本课题受到浙江省自然科学基金重大项目的支持。
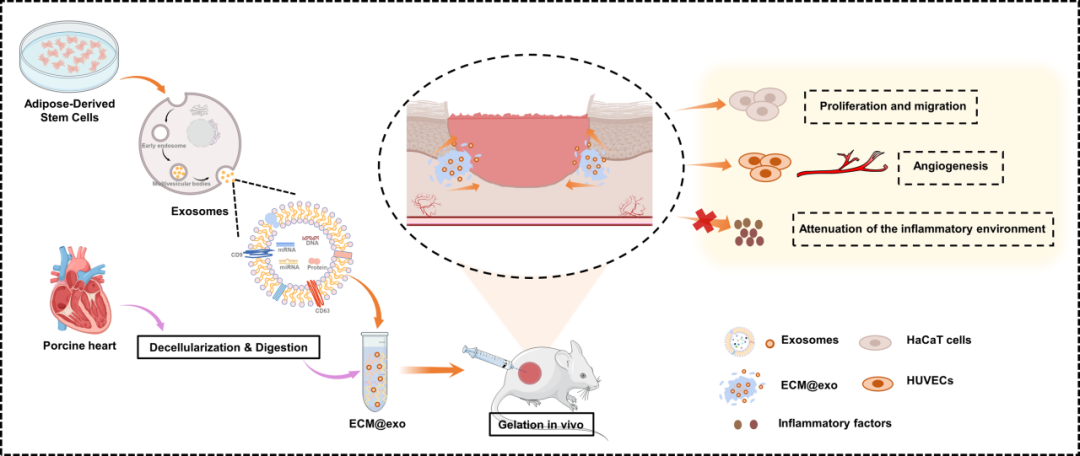
负载间充质干细胞外泌体的细胞外基质水凝胶(ECM@exo)的制备示意图及其在促进创面愈合过程中的应用
该脂肪来源间充质干细胞外泌体嵌合细胞外基质(ECM@exo)具有温度响应的特征,注射ECM@exo于创面周围,可在生理条件下形成水凝胶,赋予外泌体良好的生长环境和缓释效应,以维持创面周围的外泌体浓度。细胞外基质水凝胶提取于正常组织,是细胞生长的直接环境,具有低免疫排斥性、低细胞毒性和良好的生物相容性等优点。体内外实验结果表明,无论是在普通创面模型还是在晚期糖尿病创面模型中,ECM@exo都能够降低炎症水平、促进创面处的细胞(包括内皮细胞和表皮细胞等)增殖和迁移、促进微血管形成、加速胶原沉积,显著提高创面修复的速度和质量,使创面恢复正常的生理结构和功能。
“细胞疗法”近年来已成为当今生物医药领域最热门的赛道之一,被业界誉为继药物治疗和手术治疗之后的第三次医学革命。作为可能颠覆常规治疗手段,细胞治疗在多种重大疾病方面有着极大的潜能。目前,CAR-T细胞治疗技术是产业化步伐最快的免疫细胞治疗技术,全球已有多个产品上市并进入临床阶段。四十多年来,T 细胞激活的双信号模型帮助研究者们更好地理解了适应性免疫反应。根据该模型,T 细胞的有效激活需要T 细胞受体TCR/CD3 复合物(信号1)和共刺激信号2同时进行刺激,由此涌现出了许多通过T细胞激动剂提供激活信号的肿瘤免疫治疗方案。然而,T细胞的稳定、高效激活不仅需要信号1和信号2同时存在,还需要较高的信号刺激强度。
我院转化药学创制中心高端透皮制剂项目杜永忠教授团队发明了一种光控双信号刺激纳米激动剂,用于T细胞的在体激活,实现了肿瘤的安全高效治疗。研究成果以“A photo-activable nano-agonist for the two-signal model of T cell in vivo activation”为题发表在Journal of Controlled Release上(全文链接https://doi.org/10.1016/j.jconrel.2023.08.033)。本文第一作者为浙江大学药学院博士研究生尤雨婵,通讯作者为浙江大学药学院杜永忠教授、浙江大学丽水医院纪建松教授与南京理工大学李伟硕副教授。本课题受到国家重点研发计划“政府间国际科技创新合作”项目、国家自然科学基金和浙江省自然科学基金重大项目的支持。
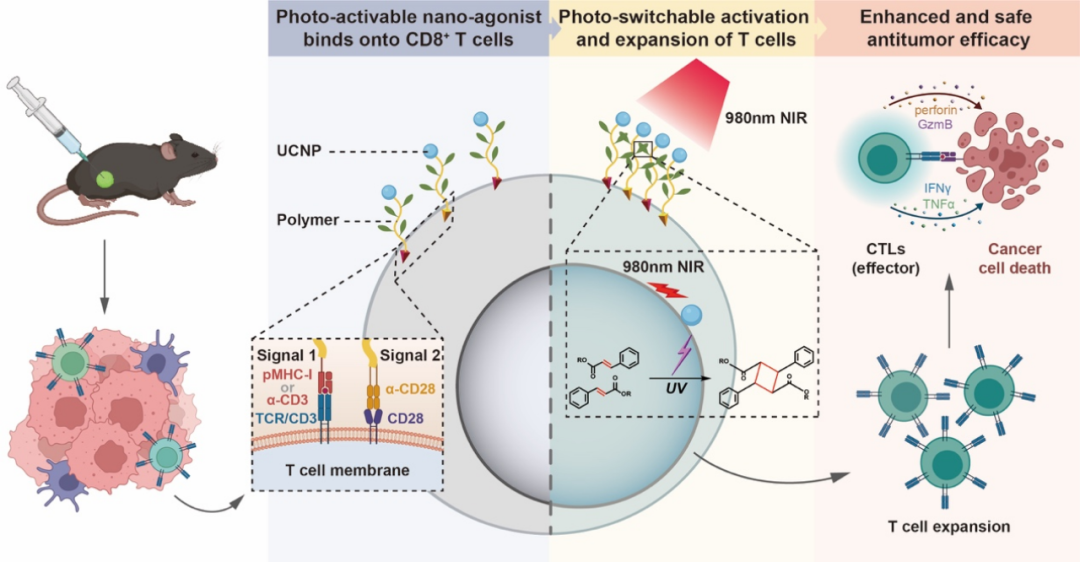
该研究将紫外光下可交联的高分子聚合物接枝在具有高效近红外光-紫外光转换效率的上转换纳米颗粒表面,再将抗原肽-主要组织相容性复合物(pMHC-I,信号1)和共刺激分子anti-CD28(αCD28,信号2)缀合到聚合物末端而得到光控双信号刺激纳米激动剂(SPU)。研究结果表明,该光控双信号刺激纳米激动剂瘤内注射后,能够结合至CD8+ T 细胞表面,在两种刺激信号同时存在下,显示出有限的抗肿瘤作用;而在肿瘤局部照射近红外光后,由于UCNP将近红外光转换为紫外光,诱导聚合物交联,进而促使相应的激动性受体高度聚集,这种增强的受体聚集通过调节下游信号传导,最终导致T细胞的高效激活和扩增,从而发挥抗肿瘤功效。光控纳米激动剂良好的免疫激活和抗肿瘤作用在小鼠黑色素瘤和乳腺癌模型的不同肿瘤分期中均得到了验证。该研究基于T细胞激活的双信号模型构建了一种在体有效且安全高效的光控纳米激动剂,具有良好的体内应用潜力和价值。