Nature子刊 | 创面无疤痕修复:浙江大学顾臻/张宇琪团队研发智能控释微针贴
目前,针对慢性难愈性创面的临床治疗依然面临着众多挑战:一方面,治疗药物的递送效率会受到细菌被膜等生理屏障的严重影响,另一方面,如何在创面愈合的不同阶段动态给与合适的药物也是影响创面愈合的重要因素之一。经典的创面愈合过程主要包括止血、炎症、增殖和重塑四个阶段,其中免疫微环境的调节是促进这一过程循序渐进的关键因素。然而,免疫调节功能障碍可能导致慢性创面的发生并使愈合过程停滞在炎症期。值得注意的是,早期持续的炎症反应会导致皮肤功能不足并且形成疤痕。因此,对慢性创面微环境在不同修复阶段的程序性调节或可解决临床治疗的瓶颈。
近日,浙江大学药学院、金华研究院、浙江大学医学院附属第二医院、附属邵逸夫医院团队开发了一种可程序性调控创面愈合的核壳微针(Core-Shell Structured Microneedle with Programmed Functions,PF-MN),以此来加速慢性创面愈合速度,并改善创面修复质量。通过设计具有活性氧(ROS)响应性外壳和免疫调节功能内核的微针贴片,可以对炎症、增殖和重塑期进行相应的动态调控。研究团队在小鼠和兔子的动物模型上验证了该贴片在促进创面愈合的同时,也可促进创面的无疤痕修复。相关研究以“Scarless wound healing programmed by core-shell microneedles”为题发表于最新期的Nature Communications上。论文第一作者是浙江大学药学院硕士研究生张颖和博士后王慎强,通讯作者为浙江大学顾臻教授、张宇琪研究员和王慎强博士。
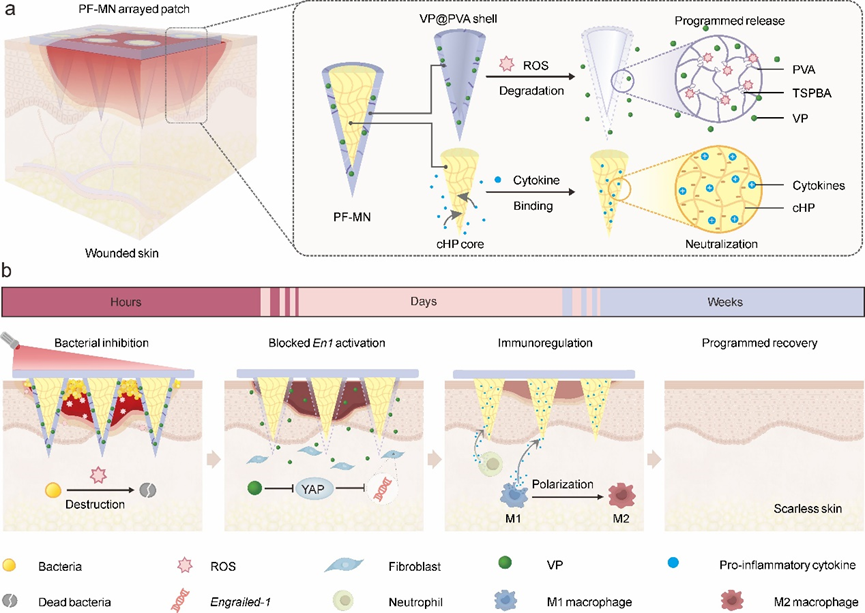
PF-MN由ROS响应的聚乙烯醇外壳和光交联的肝素内核所构成,同时在外壳上负载了光敏剂维替泊芬(图1)。在创面出现早期,微针可以有效穿透慢性创面形成的细菌生物被膜,并且外壳中所负载的维替泊芬可在激光照射下产生活性氧用以抑制细菌生物膜;在进入炎症期阶段后,微针外壳在高ROS的创面环境中可逐步降解并暴露出微针内部带有负电荷的肝素来中和各种促炎因子,以此来促进创面从炎症期过渡到增殖期;此外,释放的维替泊芬可以通过阻止成纤维细胞Engrailed-1基因的激活来抑制疤痕形成。
图1 核壳结构微针贴片程序性调控创面愈合的机制示意图
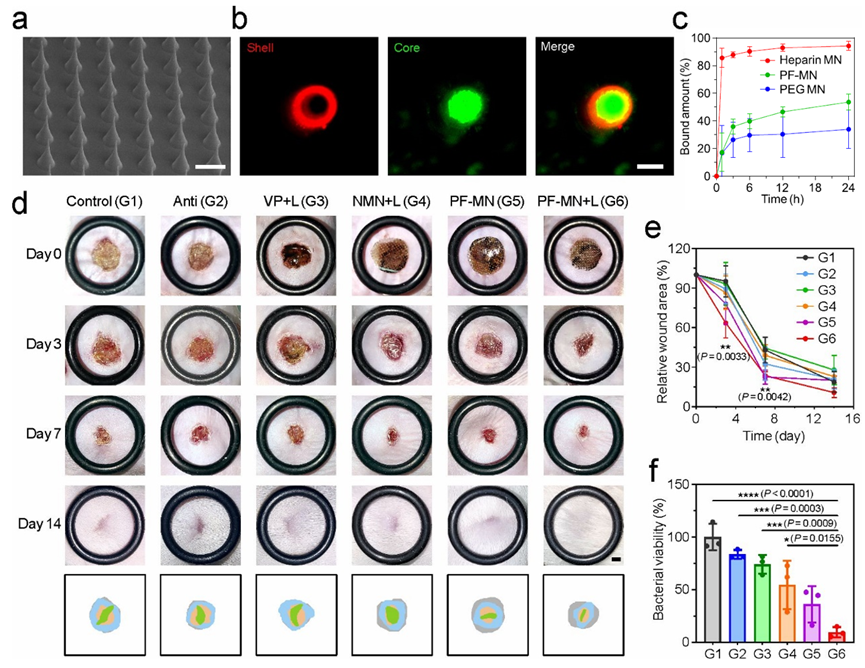
在小鼠急性创面模型中的研究表明,,该微针贴片可促进创面的无疤痕修复。而在糖尿病小鼠耐甲氧西林金黄色葡萄球菌(MRSA)感染的慢性创面模型中,实验结果证明PF-MN贴片可以有效调节创面的免疫功能,实现对慢性创面愈合的促进功能(图2)。此外,在兔耳疤痕模型中,也观察到微针贴片可以抑制增生性疤痕的形成。
图2 PF-MN的形貌表征及其促进慢性创面愈合的体内评价。a-b) PF-MN的形貌及核壳机构表征,标尺:500微米(左),100微米(右)。c)微针内核可中和促炎因子。d-f) PF-MN对小鼠慢性创面愈合的促进作用。标尺,2毫米。
该研究开发了一种程序性调控慢性创面愈合的技术方法,并通过对创面免疫环境的动态调节,实现创面的无疤痕愈合。该技术为设计随生理/病理进程变化而动态调控微环境,以实现组织修复的目的提供了新的思路。
论文链接:https://www.nature.com/articles/s41467-023-39129-6