浙江大学顾臻/俞计成团队Matter:仿生T细胞功能的血小板偶联药物 | Cell Press对话科学家
物质科学
Physical science
2023年5月19日,浙江大学药学院、金华研究院团队在Cell Press细胞出版社期刊Matter上发表了一篇题为“T Cell-Mimicking Platelet-Drug Conjugates”的最新研究。他们开发了一种具有模拟T细胞靶向识别,激活并释放细胞毒素来杀伤肿瘤细胞的工程化血小板,能够实现不依赖免疫激活的细胞治疗。这种策略为开发靶向细胞疗法治疗癌症和其他疾病提供了新的机会。论文第一作者是浙江大学药学院博士后杨银贤,通讯作者为浙江大学顾臻教授和俞计成研究员。
▲长按图片识别二维码阅读原文
肿瘤转移是导致癌症治疗失败和多数患者死亡的主要原因,而转移是通过原发肿瘤脱落的循环肿瘤细胞(CTCs)的血源性传播来实现的。在转移扩散过程中,血小板可以被肿瘤细胞招募和激活,并直接与CTCs相互作用,形成血小板-CTCs聚集体,从而促进肿瘤的转移。此外,血小板还参与早期转移灶的形成,能够主动地靶向新生的转移病灶。而肿瘤转移一旦形成,目前传统的治疗方法往往不能有效地对其进行治疗。因此,如何对CTCs进行高效杀伤以抑制肿瘤转移对提升癌症患者的生存率具有重要意义。
近日,浙江大学药学院、金华研究院团队通过将人工合成的颗粒酶B和穿孔素毒性蛋白复合物武装到血小板上,开发了一种具有能够模拟T细胞杀伤功能的血小板偶联药物(Platelet-Drug Conjugates,PDCs),以抑制肿瘤的转移扩散。PDCs利用血小板靶向CTCs和新生转移灶的特性,能够实现颗粒酶B和穿孔素的肿瘤靶向递送和智能激活释放,进而模拟T细胞的杀伤机理来消灭肿瘤细胞(图1)。研究团队在小鼠的黑色素瘤和乳腺癌转移模型上验证了该血小板偶联药物能够有效抑制肿瘤转移的形成,从而延长肿瘤转移模型小鼠的生存期。
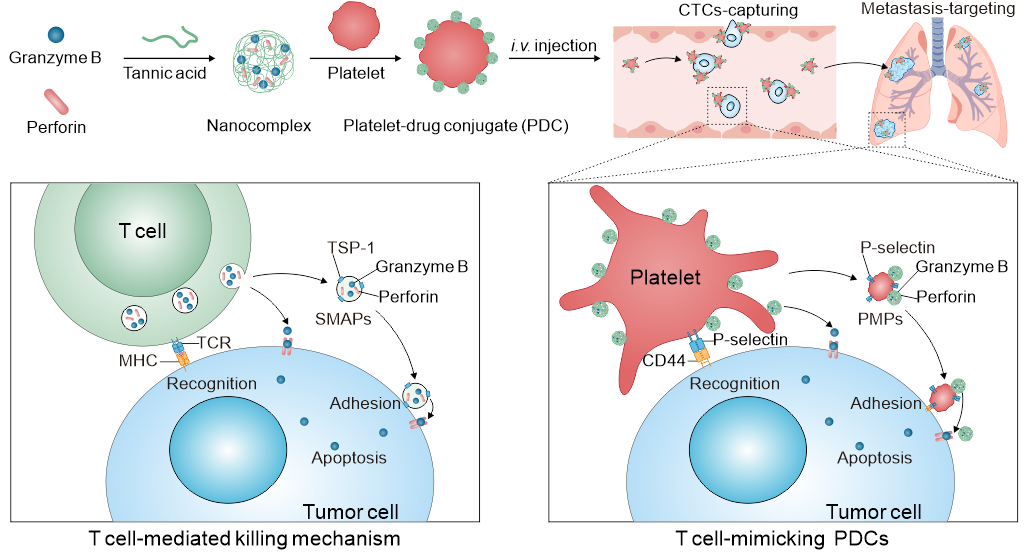
图1. 仿生T细胞的血小板偶联药物的构建和作用机制示意图。
PDCs主要由人工合成的颗粒酶B-穿孔素蛋白复合物和血小板组装而成。静脉注射给药后,由于血小板对CTCs的特异性识别,以及肿瘤新生血管和炎性肿瘤微环境对血小板的招募,PDCs能够靶向循环肿瘤细胞和新生肿瘤转移灶。一旦PDCs被肿瘤细胞相关的炎症因子激活(图2),血小板α颗粒内的P-选择素会被转运到血小板表面,其与肿瘤细胞表面的CD44相互作用,能增强血小板与癌细胞的识别和粘附。随后,被激活的PDCs释放血小板微粒(PMPs)及细胞毒性蛋白药物复合物,其中的穿孔素能够协助颗粒酶B进入肿瘤细胞引发凋亡。
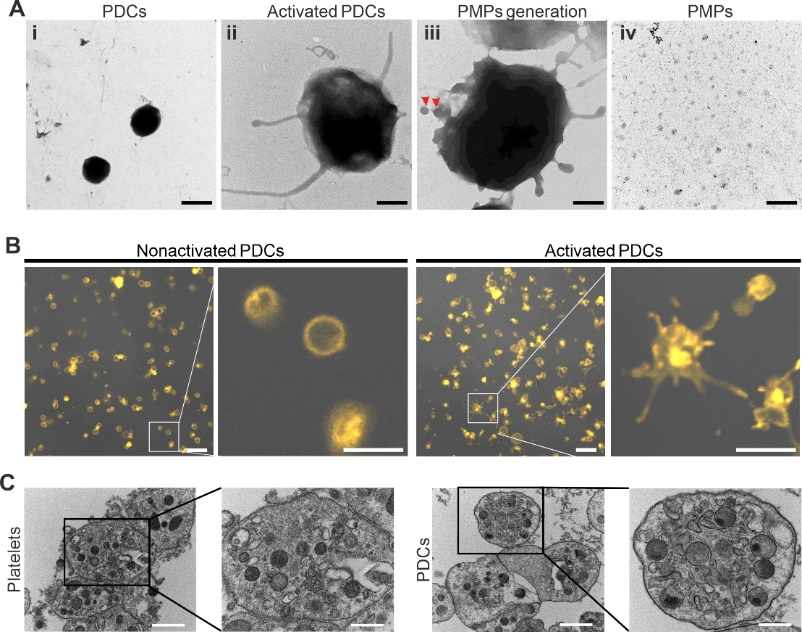
图2. PDCs的激活。(A)PDCs激活前后的透射电镜图。(B)PDCs激活前后的免疫荧光图片。(C)PDCs和正常血小板内部颗粒结构的电镜图。
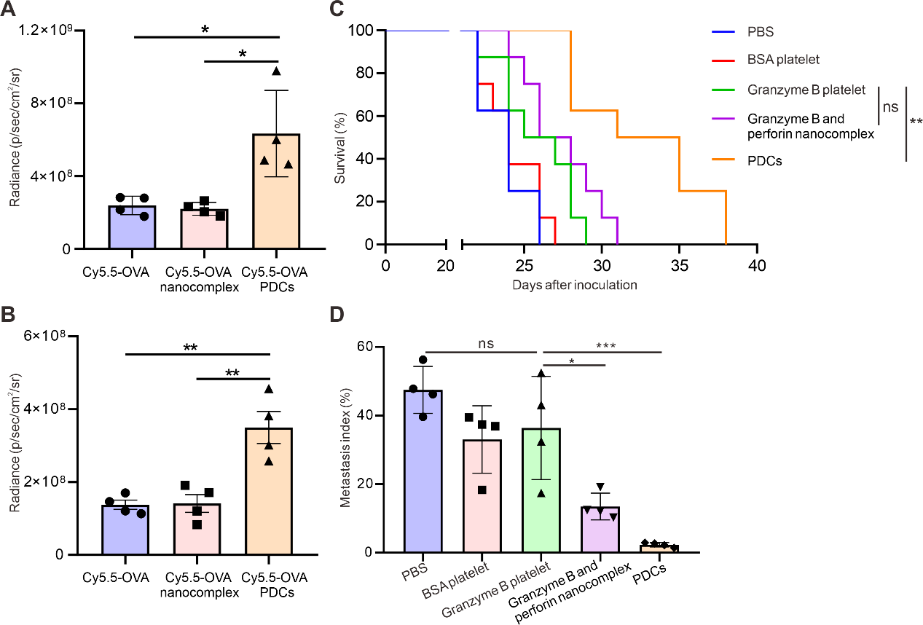
在小鼠4T1乳腺癌转移模型中的研究证实,PDCs能够靶向肿瘤新生转移灶,提高蛋白复合物的靶向递送效率,进而抑制肿瘤转移的生成,有效延长了4T1乳腺癌肿瘤转移模型小鼠的生存期。此外,该团队在B16F10黑色素瘤转移模型小鼠中进一步验证了PDCs的有效性和安全性(图3)。
图3. PDCs靶向转移灶并抑制肿瘤转移。PDCs注射(A)12小时和(B)24小时后在肿瘤转移模型小鼠中的肺部蓄积。(C-D)PDCs延长B16F10转移模型小鼠的生存期,并降低小鼠肺部的转移指数。
该研究开发了一种具有模拟T细胞靶向识别,激活并释放细胞毒素来杀伤肿瘤细胞的工程化血小板,能够实现不依赖免疫激活的细胞治疗。这种策略为开发靶向细胞疗法治疗癌症和其他疾病提供了新的机会。
作者专访
CellPress:
癌症治疗药物,尤其是针对癌转移治疗的靶向药物开发一直是药物开发领域的研究热点。请问顾教授,您认为目前该领域面临的主要困难和挑战都有哪些?对此,国内外的研究团队都是如何来进行突破的?
顾臻教授:
转移是癌细胞从原发性肿瘤扩散到周围组织以及远处器官的过程,是造成癌症死亡的主要原因。目前针对癌转移治疗的靶向药物是根据相关靶点来设计的,以实现精准治疗。与此同时,开发新型药物递送系统来提高现有药物的靶向治疗效果近年来备受关注。
如何将药物靶向递送到癌细胞,使得药物精准杀伤癌细胞,把对正常细胞的伤害降到最低?基于此思路,国内外研究学者开发了各种靶向药物递送系统,来抑制肿瘤新生血管生成、阻止上皮间质转化、抑制新生转移灶、增强自身免疫等。其中,纳米药物递送系统利用纳米颗粒作为载体,调控药物在体内的靶向分布和释放,特异地靶向病灶并发挥作用。比如,基于合成脂质的递送系统包括胶束、脂质体和脂质纳米颗粒被广泛用于小分子、核酸和蛋白药物的递送;仿生载体如工程化细胞、外泌体等也被开发用于肿瘤药物的靶向递送。此外,研究者们还合成了一系列的肿瘤微环境调控材料和免疫治疗系统来抑制肿瘤转移。如何提高这些创新制剂的转化成效是我们聚焦的努力方向。
CellPress:
本文中,您和您的研究团队设计了一种模拟T细胞杀死机制的血小板药物偶联物,且通过肿瘤模型实验证明,该偶联物可有效地消除循环肿瘤细胞并抑制肿瘤转移。请问顾教授,将T细胞杀伤机制与血小板修饰相结合的偶联药物的设计灵感是如何产生的呢?血小板药物偶联物对癌转移治疗有什么优势?
顾臻教授:
本研究是基于团队前期工程化血小板药物递送系统的积累和 T 细胞分泌的毒性复合物结构最新研究进展提出的。我们团队前期(Nature Biomedical Engineering,2017、2018、2021)提出了血小板荷载免疫检查点抑制剂 PD-L1 技术,PD-1 血小板与造血干细胞化学结合技术、以及血小板联合 CAR-T 免疫细胞治疗策略。团队在国际上率先通过利用血小板的天然靶向特性递送药物,在小鼠模型上验证了该策略可有效将药物募集至术后和肿瘤转移部位,提高药效。
最新研究进展(Science, 2020; Nature Communications, 2022)确定了T细胞毒性复合物,并非直接被释放到靶细胞周围,而是互相结合,组装成一个超分子攻击粒子(SMAP),释放到靶细胞细胞膜上。SMAP主要由颗粒酶B和穿孔素组成的核心,以及血小板反应素-1(TSP-1)的外壳组成。值得注意的是,通过TSP-1靶向定位的SMAP可以在没有T细胞的情况下自主杀伤肿瘤细胞。现有的免疫疗法主要通过激活T细胞来杀伤肿瘤,而复杂的肿瘤转移微环境却导致免疫逃避。因此,可以人工合成SMAP,模拟T细胞杀伤机制来进行癌症治疗,绕开免疫细胞治疗的局限性。
在肿瘤转移过程中,血小板与循环肿瘤细胞(CTCs)形成血小板-CTCs聚合体,同时血小板不断巡视血管,使其能够主动地靶向新生的转移病灶。基于此,我们提出人工合成颗粒酶B和穿孔素组成的毒性蛋白复合物,利用血小板特异性靶向和智能激活的生理特征,构建具有模拟T细胞杀伤机制的血小板细胞疗法。血小板偶联药物在体内能靶向CTCs和新生肿瘤转移灶,提高了蛋白药物的靶向递送效率,同时利用血小板响应肿瘤生理信号而激活来实现药物的智能释放。血小板偶联药物能模拟T细胞的机制来杀伤肿瘤细胞,潜在为免疫不响应和低响应患者提供了一种治疗策略,同时可避免了免疫耐药性和相关的不良反应。
CellPress:
请问顾教授,这篇研究工作对于未来癌症治疗靶向药物的开发设计具有什么样的启发和借鉴意义呢?
顾臻教授:
目前药物递送领域的一些瓶颈包括:如何使得药物的递送更加精准可控,减少药物的脱靶问题?本研究利用血小板作为递送载体,提高蛋白药物的靶向递送和智能激活释药的效率,进而构建成模拟T细胞杀伤的血小板偶联药物,可实现靶向CTCs和新生肿瘤转移灶的递送,有望实现阻断转移并抑制肿瘤转移灶的生长。本项目设计的模拟 T 细胞的血小板偶联药物可作为免疫细胞疗法的替代选择,为抑制肿瘤转移提供新的治疗策略,为构建工程化细胞递送系统提供了一些新思路。
CellPress:
请问顾教授,您认为本研究工作中的血小板药物偶联物在最终用于临床治疗的过程中会遇到哪些挑战?以及相应的解决方案?
顾臻教授:
我们团队于2017年初率先提出了基于血小板偶联药物的靶向递送策略,对血小板进行工程化改造,帮助药物更好的靶向递送。作为递送药物的载体,血小板具有独特的优势,其体内靶向性强,且没有细胞核,不会将外源DNA带到患者体内,降低了潜在的副作用。同时,由于血小板可以从患者身上提取,这可以将治疗的免疫原性降到最低。未来的研究将优化血小板药物偶联物的颗粒负载率、偶联方法、给药剂量、频率和储存条件等,以提高血小板偶联药物的临床转化能力。我们团队也在最近完成了一项关于血小板偶联药物的研究者发起的临床试验(IIT)注册,即将启动首例人体实验。
CellPress:
请问顾教授,您和您的团队接下来是否还会继续在癌症治疗的靶向药物开发领域开展新的研究工作?未来您期待在该领域达成怎样的研究目标?
顾臻教授:
会的,这是我们团队主要的研发方向之一。我们致力于将生物材料设计、生物分子工程和微纳加工技术整合到新的药物递送策略中,实现以剂量、空间和时间可控的方式递送和释放治疗药物。我们目前的研发重点是利用器械和细胞载体或仿生合成载体进行生理响应性的药物递送。同时,我们也特别重视科研成果的转化,坚持问题与产品导向,开展药物递送制剂及器件的研发。我们的目标是开发变革性的药物递送系统,提升药物的治疗效果和安全性,特别用于治疗癌症和糖尿病。
CellPress:
最后请顾教授和我们分享下您选择Matter的理由。
顾臻教授:
由Cell Press出版的Matter是本年轻的充满活力与潜力的期刊,作为Cell的姊妹刊,它秉承了Cell的高标准、高质量和高影响力,具有广泛的读者群。Matter涵盖材料科学的微观及宏观领域、基础及应用研究,体现很强的学科交叉属性。我们这项工作涉及到生物材料、细胞工程以及药物递送领域的研究,投稿时觉得整体创新性和学科交叉性与Matter的特质挺搭。我们希望和相关领域的学者“以文会友”,共同促进相关技术的创新与转化。
![]()

作者介绍

顾臻 教授
顾臻(通讯作者,guzhen@zju.edu.cn)浙江大学求是讲席教授、药学院院长,浙江大学金华研究院院长,教育部“长江学者”,先进药物递释系统全国重点实验室主任,浙江省先进递药系统重点实验室主任,国家重点研发计划项目首席科学家。本科、硕士毕业于南京大学化学系及高分子科学与工程系;2010年于加州大学洛杉矶分校(UCLA)获得工学博士学位;同年博士后获聘于麻省理工学院化工系/Koch癌症综合研究院、哈佛大学医学院。2012-2018年任教于北卡罗莱纳大学教堂山分校/北卡州立大学联合生物医学工程系,获评Jackson Family杰出讲席教授。2018-2020年任UCLA生物工程系正教授,并任生物技术/生物医学与工程培训中心主任。2020年9月全职受聘于浙江大学。其指导的“iMedication-智能医药实验室”研究方向包括生物大分子(蛋白质/核酸)递药系统、生理响应材料、免疫治疗制剂、细胞治疗策略等。目前已发表学术论文290余篇,授权企业专利150余项。顾臻教授曾获“斯隆研究奖”、英国皇家化学会Felix Franks奖章、国际药物控释学会(CRS)“青年学者奖”、美国糖尿病学会(ADA) “Pathway”研究奖等。《麻省理工科技评论》曾将其评为“世界青年创新家”。2019年当选美国医学与生物工程院会士,2021年当选国际医学与生物工程院会士。其课题组首次报道了血糖响应“智能胰岛素贴片”的原型,提出了闭路透皮递药系统的新概念,并率先利用血小板的靶向性及脂肪细胞的代谢通路递送药物,2项相关技术进入到临床试验研究阶段。

俞计成 研究员
俞计成(通讯作者,yujicheng@zju.edu.cn)浙江大学百人计划研究员、博士生导师。本科、硕士毕业于南京大学匡亚明学院及化学化工学院高分子科学与工程系,2018年获得北卡罗莱纳大学教堂山分校及北卡罗莱纳大学联合生物医药工程博士学位。2018-2022年间任美国生物医药创新公司Zenomics Inc.首席科学家。2022年1月全职加入浙江大学药学院。研究方向包括生理响应性材料、智能药物递送器件等。目前已在Nature Biomedical Engineering、Matter、PNAS、Science Advances等期刊发表论文60余篇;申报专利30余项,其中20余项专利已授权给相关医药公司。主持国家自然科学基金优秀青年基金(海外)项目和面上项目等多项科研项目。

杨银贤 助理研究员
杨银贤(第一作者,yangyinxian@zju.edu.cn),浙江大学博士后,助理研究员。2021年6月于沈阳药科大学获药剂学博士学位,师从孙进教授和何仲贵教授,研究前药自组装和智能药物递送系统用于癌症治疗。2021年8月加入顾臻教授iMedication Lab团队从事博士后研究。主要研究方向为利用血小板和细胞载体或仿生合成载体进行生理响应性的药物递送。目前以第一作者身份在Science Advances、Matter、Angewandte Chemie International Edition、Nano Letters和Nano Today等期刊发表论文9篇,并申请相关发明专利5项。主持中国博士后科学基金面上资助项目,并参与国家自然科学基金重点项目和面上项目。