喜报!我院小分子创新药团队于ACS Central Science发表重要学术论文
近日,浙江大学金华研究院转化药学创制中心小分子创新药团队李丹教授与浙江大学药学院侯廷军教授、北京大学化学学院唐淳教授合作,在国际知名期刊 ACS Central Science 上发表了一篇题为《前列腺癌靶向治疗新策略:小分子拮抗剂抑制雄激素受体配体结合域二聚》的研究论文,该成果将有望为前列腺癌的靶向治疗提供新思路。
背景介绍
在全球范围内,前列腺癌是男性发病率排名第2,并且死亡率为第5位的恶性肿瘤。靶向雄激素受体(androgen receptor,AR)是治疗前列腺癌重要的策略之一。当前,已上市的AR靶向药物均为特异性地靶向其配体结构域(LBD)的配体结合口袋(LBP)以竞争天然的配体雄激素(睾酮和二氢睾酮)。然而,不可避免的获得性耐药限制了这些上市药物的临床效益。除了配体结构域的配体结合口袋,目前已经开发了多种类型的AR拮抗剂,可靶向其不同的结构域。然而,除了LBP,目前尚无靶向AR其余位点的拮抗剂上市,该领域的研究亟待进一步的深入和拓展。AR作为成熟的成药性靶标,开发作用于全新位点并具有全新结构的拮抗剂,对于克服已有药物耐药性,为患者提供新的治疗选择具有重要的临床价值。
文章亮点
1. 受雄激素不敏感综合征和分子动力学模拟研究结果的启发,作者发现了AR LBD二聚体界面结合位点(DIP)是一个全新的潜在药物分子结合位点。
2. 结合计算机辅助药物设计技术(CADD)苗头化合物发现和化学结构修饰,作者基于新位点DIP发现了具有开发潜力的AR拮抗剂M17-B15。
3. 除了AR的DIP具有开发潜力,多个相关的核受体存在类似区域,这一发现为相关核受体的DIP靶向分子的开发提供了重要参考。
图文解读
反向思考,发现AR上新的活性分子结合位点
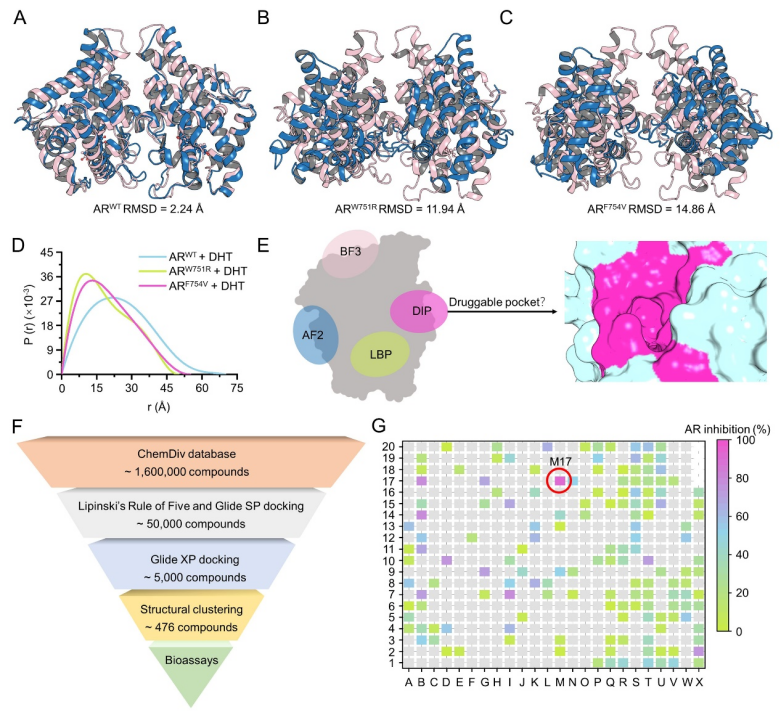
雄激素在生殖和非生殖系统的正常生理、发育和代谢过程中具有重要的作用。雄激素与其受体AR结合后,会诱导 AR 的构象变化,进而使其与热休克蛋白解离、AR 发生二聚化以及从胞质转运到细胞核中,随后与雄激素反应元件的特定 DNA 区域结合,发挥相关功能。异常的AR活性与多种疾病相关,如前列腺癌和雄激素不敏感综合征等。众多AR LBD 界面间的氨基酸残基点突变与雄激素不敏感综合征密切相关,即在正常水平的雄激素状态下,AR无法发挥其正常的功能。作者猜测其与氨基酸残基点突变破坏AR二聚相关。因此,作者选取野生型AR LBD二聚体(ARWT)晶体结构、以及构建了雄激素不敏感综合征相关的代表性氨基酸残基点突变W751R(ARW751R)和F754V(ARF754V)二聚体进行分子动力学模拟,模拟发现ARWT能够保持二聚体稳定,而ARW751R和ARF754V在模拟中则均很容易被分离(图1A-C)。在模拟结果的基础上,作者纯化了这三种蛋白,采用小角X光散射实验进一步证实了这一结果,即AR LBD的二聚体界面上的点突变可以破坏二聚体的稳定性(图1D)。
作者反向思考,大胆假设靶向AR LBD二聚体界面的活性小分子有可能抑制AR的二聚,从而抑制AR的活性,最终达到抗前列腺癌的目的(图1E)。通过结构分析,作者发现AR LBD二聚体界面的确存在一个分子结合空腔,而这个结合空腔是否可以成为小分子的结合位点,尚未可知。为了验证这一猜想,作者整合多种CADD技术,筛选了商业化合物库约160万个分子,最终选取了476个分子进行实验验证,并发现了苗头化合物M17(图1F-G)。
▲ 图1. (A-C)分子动力学模拟前(粉红)和后(蓝色)ARWT、ARW751R和ARF754V叠合图;(D)小角X光散射证明氨基酸残基点突变会破坏AR LBD的二聚;(E)AR LBD界面存在全新的结合口袋;(F)计算机虚拟筛选化合物库流程图;(G)476个化合物抑制AR活性结果。
基于CADD辅助,发现活性提升约31倍的AR拮抗剂M17-B15
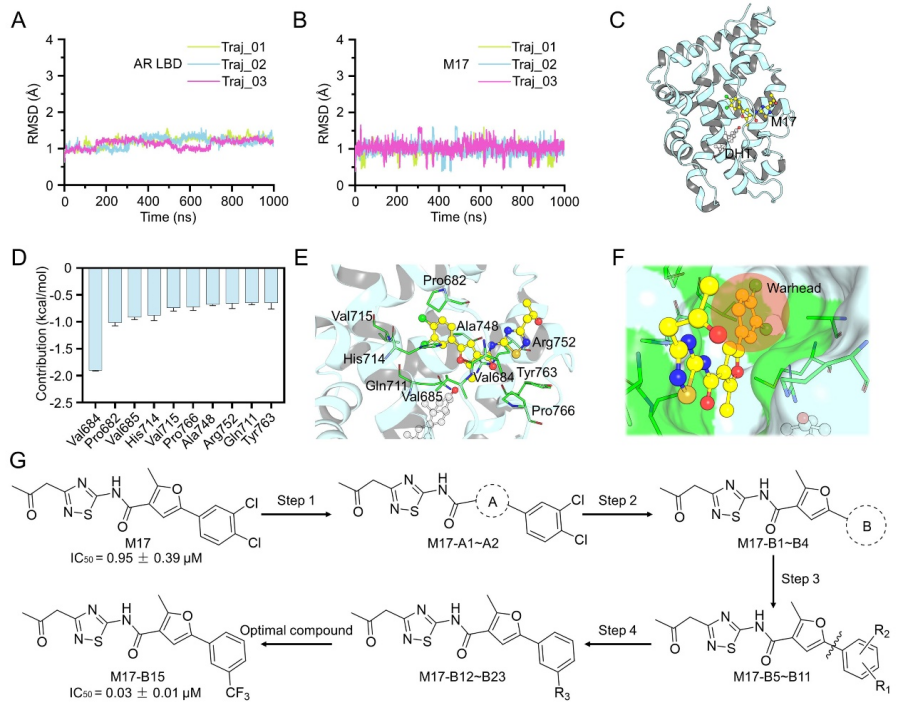
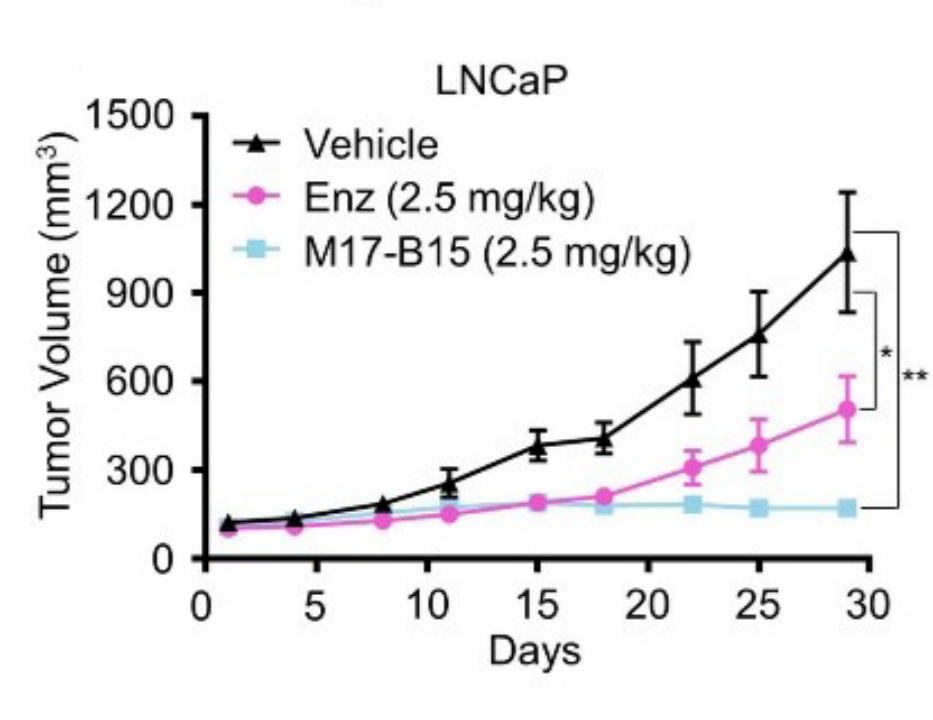
考虑到苗头化合物活性方面距离上市药物依旧有很大的差距,作者结合分子动力学模拟、关键氨基酸残基分解的分析以及4轮药物化学构效关系分析和优化,最终获得了相比苗头分子M17抑制AR转录活性提升了约31倍的M17-B15,达到和上市药物恩杂鲁胺同等水平(图2)。在小鼠移植瘤模型中,同为瘤内注射情况下,M17-B15展现优于恩杂鲁胺的抑制肿瘤生长活性(图3)。
▲ 图2. 计算机模拟构建M17结合在AR LBD 二聚体界面的结合模式(A-F)和M17结构优化4步路线图(G)。
▲ 图3. M17-B15抑制LNCaP细胞小鼠移植瘤模型
总结与展望
AR作为核受体家族一个热门的成药性靶标,发现新的分子结合位点对于AR的靶向治疗具有重要的临床和商业价值。本文在雄激素不敏感综合征的理论分析和实验验证的基础上,提出了一个极具潜力的全新位点AR DIP,并结合CADD技术、化学修饰、分子生物学和药理学实验等多学科,发现了体内外具有优异活性和选择性的全新AR拮抗剂M17-B15。此外,核受体家族还有很多核受体存在DIP位点,也是未来靶向治疗研究的新契机。
该项目团队负责人由浙江大学药学院博士生导师,盛荣副教授所领衔,目前项目成员共有11人,包括高级职称4人,中级职称1人,博士和硕士研究生3人。
本项目团队针对肿瘤、乙肝、脑卒中等重大疾病的未满足临床需求,聚焦原创靶点,开展基于结构的新药设计,发现全新机制的临床候选分子。
项目团队已取得了一定成果,首次提出并验证靶向AR二聚结合界面的策略,经虚拟筛选与多轮次结构优化,获得全新机制抗前列腺癌候选分子DIP-1018;它避开传统靶标LBP,有望克服AR拮抗剂的耐药问题,该项目获得2023年度浙江省科技厅“领雁”研发攻关计划的资助,有望于2025年获得新药临床批件。项目团队正在与国内相关科研团队紧密合作,在肿瘤、脑卒中、乙肝、炎性疾病等领域开展新药研发合作,目前有6个靶点的新药正在积极推进中。此外,团队还创立了两家生物医药科技公司,分别开展原创新药、二类新药和高端仿制药研发。并且与金华当地多家医药企业建立长期、稳定的合作关系,共同推进金华生物医药产业的快速发展。